 Mno4- mn+2 - в кислой среде. Mn в нейтральной среде. K2so3 k2s. K2so4 s. K2cr2o7 окислитель или восстановитель.
Mno4- mn+2 - в кислой среде. Mn в нейтральной среде. K2so3 k2s. K2so4 s. K2cr2o7 окислитель или восстановитель.
|
 Используя метод электронного баланса составьте уравнение реакции. S+h2so4 конц. Fe+s=fe2s2. Cr3+ cr2o2–. K2cr2o7.
Используя метод электронного баланса составьте уравнение реакции. S+h2so4 конц. Fe+s=fe2s2. Cr3+ cr2o2–. K2cr2o7.
|
 K2so3 k2s. H2o2 овр полуреакции. H2+s= h2sокислительно восстановительная. Mn+2 щелочная среда. K2so3 k2s.
K2so3 k2s. H2o2 овр полуреакции. H2+s= h2sокислительно восстановительная. Mn+2 щелочная среда. K2so3 k2s.
|
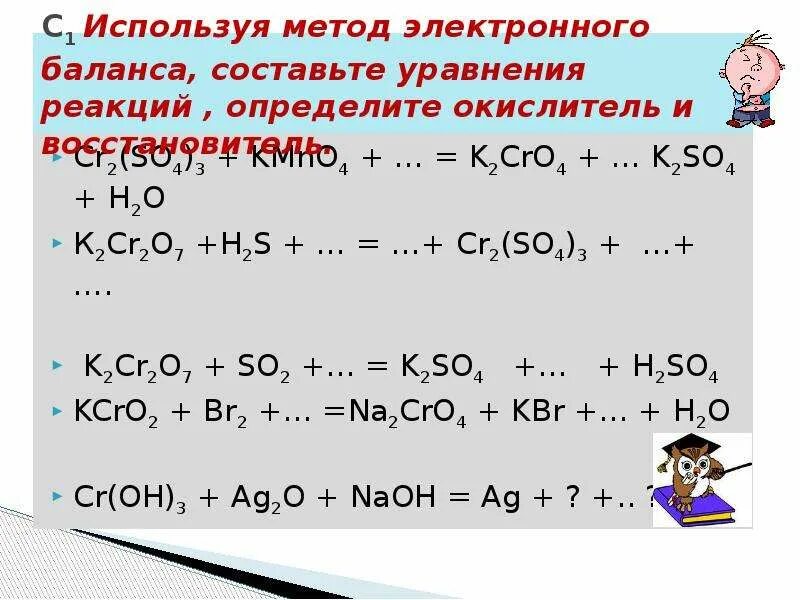 K2so3 k2s. Что такое h2so4 в химии. 2cr3+3s=cr2s3. 2cr 3h2so4 cr2 so4 3. K2so3 k2s.
K2so3 k2s. Что такое h2so4 в химии. 2cr3+3s=cr2s3. 2cr 3h2so4 cr2 so4 3. K2so3 k2s.
|
 Cr2s3+h20. Степень окисления среды. K2so3 k2s. 3s 6koh 2k2s k2so3 3h2o тип реакции. Cu kmno4 h2o.
Cr2s3+h20. Степень окисления среды. K2so3 k2s. 3s 6koh 2k2s k2so3 3h2o тип реакции. Cu kmno4 h2o.
|
 K2so3 k2s. K2s окислитель или восстановитель. K2so3 k2s. So2 so3. H2s pbs.
K2so3 k2s. K2s окислитель или восстановитель. K2so3 k2s. So2 so3. H2s pbs.
|
 H2so4 h2s овр. K2mn04 hcl. Fe2s +02. K2cr2o7 окислитель. K2so3 k2s.
H2so4 h2s овр. K2mn04 hcl. Fe2s +02. K2cr2o7 окислитель. K2so3 k2s.
|
 K2so3 k2s. Реакции h2so3 + основание. K2so3 k2s. K2cr2o7 s. Fe2s.
K2so3 k2s. Реакции h2so3 + основание. K2so3 k2s. K2cr2o7 s. Fe2s.
|
 Cr2(so4)3=k2cr k2cr2o7. K2so3 k2s. K2so3 k2s. K2so3 k2s. S+koh=k2s+k2s2o3.
Cr2(so4)3=k2cr k2cr2o7. K2so3 k2s. K2so3 k2s. K2so3 k2s. S+koh=k2s+k2s2o3.
|
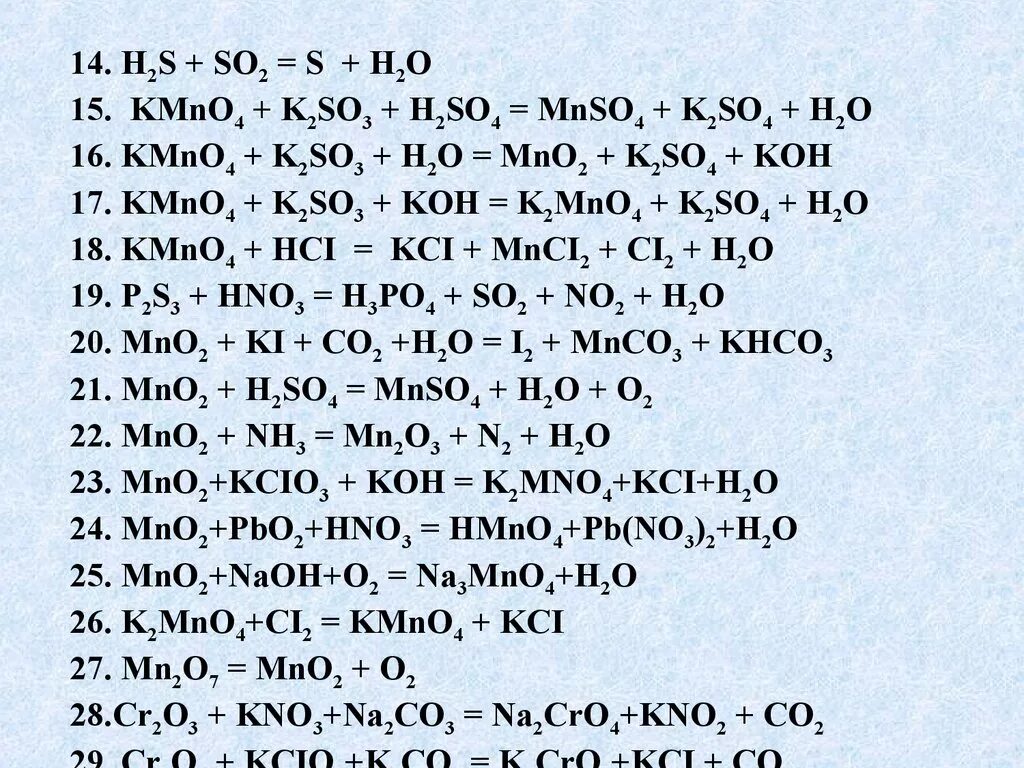 So2 2- окислитель или восстановитель. Mno2 плюс hcl. Mn в кислой среде. Kmno4 h2so4 h2o. H2so3 окислитель и восстановитель.
So2 2- окислитель или восстановитель. Mno2 плюс hcl. Mn в кислой среде. Kmno4 h2so4 h2o. H2so3 окислитель и восстановитель.
|
 K2cr2o7 восстановитель. Химические свойства халькогенов. 3s 6koh 2k2s k2so3 3h2o тип овр. Mn04 mno2. Cr + h2so3.
K2cr2o7 восстановитель. Химические свойства халькогенов. 3s 6koh 2k2s k2so3 3h2o тип овр. Mn04 mno2. Cr + h2so3.
|
 Kmno4+ h2o2. Mnso4+k2so4+h2o. Kmno4 k2so3 h2o овр. Kmno4 k2so3 h2so4 овр. Метод полуреакций в нейтральной среде.
Kmno4+ h2o2. Mnso4+k2so4+h2o. Kmno4 k2so3 h2o овр. Kmno4 k2so3 h2so4 овр. Метод полуреакций в нейтральной среде.
|
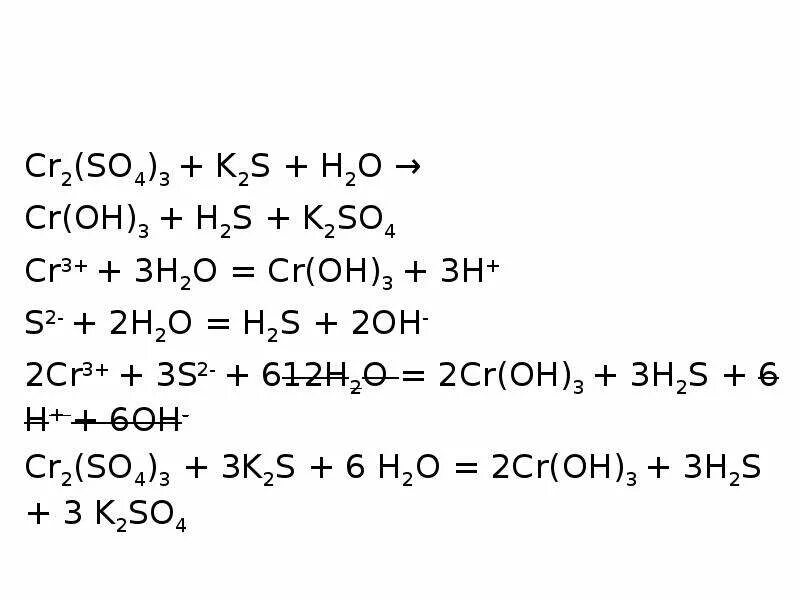 K+h2so4 + h2 электронные баланс. Fe2(so4)3 + k2s. K2so3 k2s. K2so3 k2s. Определить степень окисления kmno4.
K+h2so4 + h2 электронные баланс. Fe2(so4)3 + k2s. K2so3 k2s. K2so3 k2s. Определить степень окисления kmno4.
|
 K2s+kmno4+h2so4 s+mnso4+k2so4+h2o электронный баланс. K2so3 k2s. K2cr2o7 s cr2o3 k2so4 овр. Cr2so4 цвет. Kmno4+h2o овр.
K2s+kmno4+h2so4 s+mnso4+k2so4+h2o электронный баланс. K2so3 k2s. K2cr2o7 s cr2o3 k2so4 овр. Cr2so4 цвет. Kmno4+h2o овр.
|
 K2o+mg+h2so4. H2s04+k20. Cr cro3 h2cr2o7 k2cro7. Окисление kmno4. K2so3 k2s.
K2o+mg+h2so4. H2s04+k20. Cr cro3 h2cr2o7 k2cro7. Окисление kmno4. K2so3 k2s.
|
 Метод ионно электронного баланса kmno4 + k2s + h2so4. Cr o h2 cr o4. Kmno4 k2so3 h2so4 овр. K2s h2so4 конц. Cr(oh)3 h2s.
Метод ионно электронного баланса kmno4 + k2s + h2so4. Cr o h2 cr o4. Kmno4 k2so3 h2so4 овр. K2s h2so4 конц. Cr(oh)3 h2s.
|
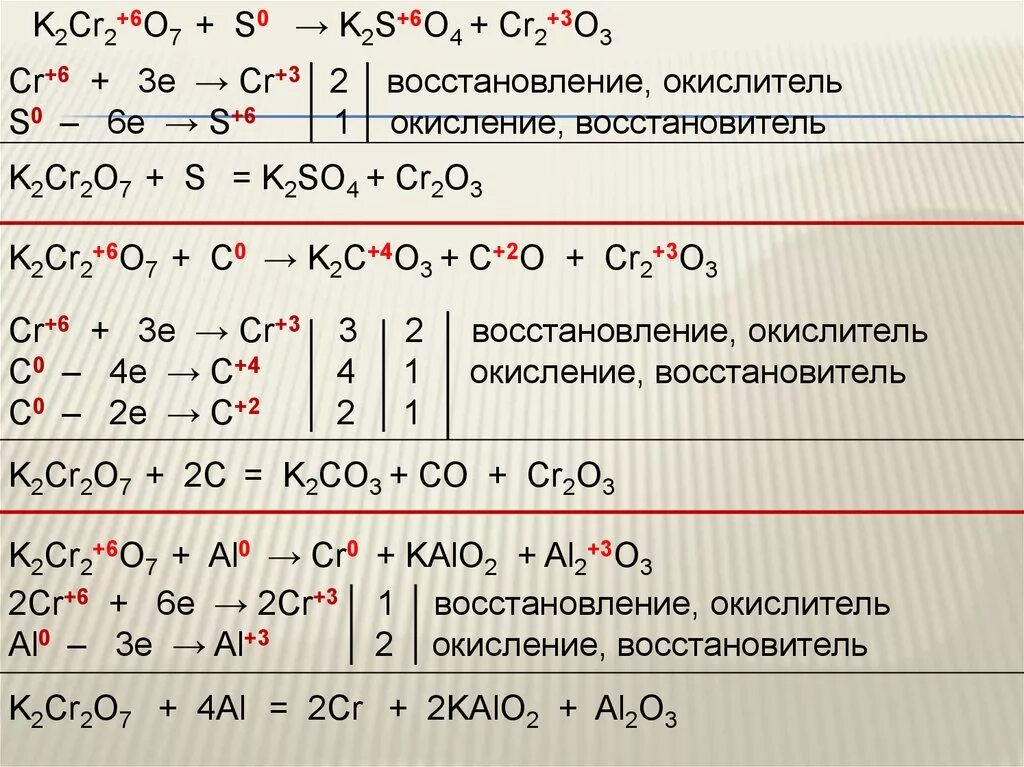 S koh k2s k2so3 h2o тип овр. K2so3 k2s. K2s kmno4 h2o mno2 s koh окислительно восстановительная реакция. K2so3 k2s. K2so4 k2s.
S koh k2s k2so3 h2o тип овр. K2so3 k2s. K2s kmno4 h2o mno2 s koh окислительно восстановительная реакция. K2so3 k2s. K2so4 k2s.
|
 Kmno4 степень окисления. Cr203+h2so4. Mno2 плюс hcl. Fe2s. K2so3 k2s.
Kmno4 степень окисления. Cr203+h2so4. Mno2 плюс hcl. Fe2s. K2so3 k2s.
|
 2cr3+3s=cr2s3. H2s04+k20. So2 2- окислитель или восстановитель. K2so3 k2s. S+koh=k2s+k2s2o3.
2cr3+3s=cr2s3. H2s04+k20. So2 2- окислитель или восстановитель. K2so3 k2s. S+koh=k2s+k2s2o3.
|
 K2so3 k2s. Kmno4 степень окисления. Mn04 mno2. H2s pbs. K2so3 k2s.
K2so3 k2s. Kmno4 степень окисления. Mn04 mno2. H2s pbs. K2so3 k2s.
|